 Inicia sesión para ver el contenido completo
Inicia sesión para ver el contenido completo
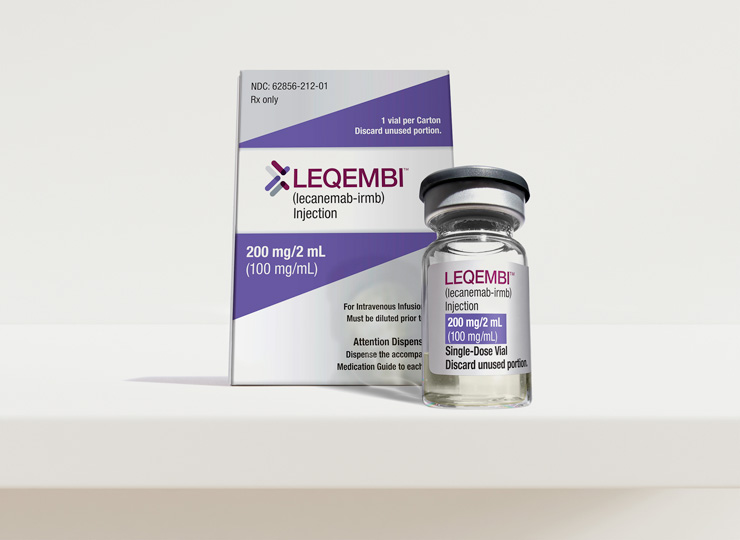
Bruselas aprueba el primer medicamento que ha demostrado ralentizar la progresión del alzhéimer

 Inicia sesión para ver el contenido completo
Inicia sesión para ver el contenido completo