 Inicia sesión para ver el contenido completo
Inicia sesión para ver el contenido completo
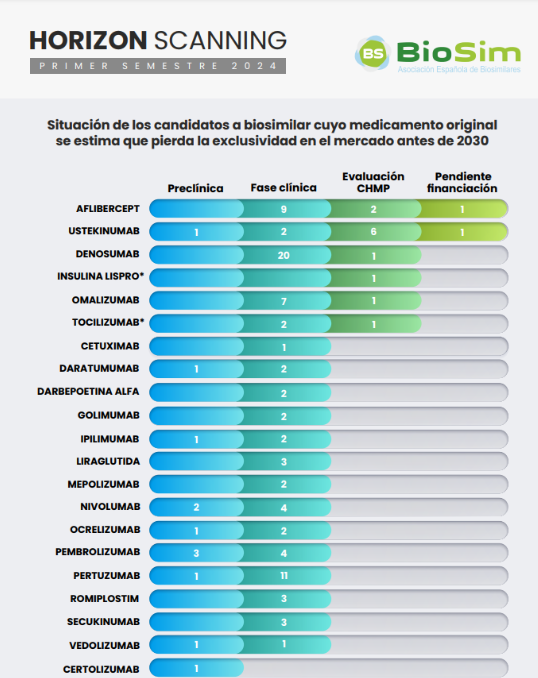
La segunda actualización del Horizon Scanning de BioSim anticipa la comercialización de tres nuevos biosimilares en 2025

 Inicia sesión para ver el contenido completo
Inicia sesión para ver el contenido completo